- Napište nám
- Kontakty
- Reklama
- VOP
- Osobní údaje
- Nastavení soukromí
- Cookies
- AV služby
- Kariéra
- Předplatné MF DNES
Jak se poznají pravé perly od napodobenin?
Dobrá rada nad zlato - a tohle je samozřejmě rada pro někoho, koho nemáte moc rádi. Trik s octem přitom znala už vzdělaná egyptská královna Kleopatra.
Podle jedné z legend se vsadila s Markem Antoniem, že zvládne projíst na jedné jediné hostině deset milionů sesterciů.
Sestercius byl v době, kdy žila Kleopatra a Markus Antonius, malá stříbrná mince, jejíž hodnota byla jedna čtvrtina denáru. Stříbrný denár vážil zhruba 4,5 gramu. Když vycházíme z dnešních cen stříbra, stál by dnes jeden sestercius zhruba 47 eurocentů, tedy 12,15 korun. Cíl byl tedy nelehký. Kleopatra problém vyřešila tím, že si nechala rozpustit v hrnku s octem velikou (a patřičně cennou perlu). Poté prý obsah hrnku vypila.
Egyptologové samozřejmě nevěří každé legendě - a tak někteří z nich o Kleopatřině žertíku pochybovali. Dnešní chemie ale dává královně za pravdu. Perly se skutečně dají rozpustit v octě. Co je ovšem daleko zajímavější - nerozpouštějí se v koncentrované octové kyselině, zato se rychle a ochotně rozpustí ve zředěném roztoku. To je na první pohled - více než zvláštní…
Záhada rychle rozpuštěné perly
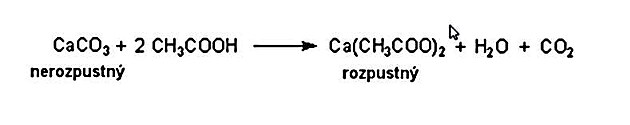
Pravé perly se skládají z materiálu, kterému se říká perleť. Příroda u nich použila trik, který dělá z perleti relativně tvrdý a odolný materiál. Jeho základem je 95 % CaCO3 - uhličitanu vápenatého ve formě aragonitu (s kosočtverečnou krystalovou modifikací, při které mají všechny hrany krystalu pravé úhly ale jeho hrany mají různé délky, podobně jako je tomu například u cihel). Už to mu dává dobrý pevný základ. Zbylých pět procent tvoří organické sloučeniny, které se ukládají mezi jednotlivé vrstvy minerálu a “lepí” je dohromady. Svým způsobem je tedy perleť podobná zdi z cihel, kde jednotlivé cihly spojuje malta.
Perla se dá rozpustit tím, že se chemicky pozmění její hlavní složka - karbonát se přemění z nerozpustné na rozpustnou variantu. Při reakci perleti a kyseliny octové pak teoreticky probíhá následující proces:
Teoreticky by se tedy mohlo zdát, že čím koncentrovanější je kyselina v roztoku vody, tím rychleji bude probíhat reakce. Je to ale klamné zdání. Platilo by to jen v případě, kdy probíhá kyselinová koroze - tedy proces, při kterém se mezi jednotlivými látkami předávají elektrony.
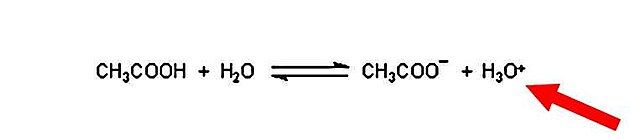
V případě perel rozpuštěných octem - se ovšem proces zakládá na přenosu protonů, nikoliv elektronů.
Kyselina může v tomto speciálním případě působit jen tehdy, když se nachází ve vodě. Té předá jedno ze svých kladně nabitých vodíkových jader.
Vodík nezůstane dlouho sám - přidá se k molekule vody a díky ní se pak může dostat až na místo určení.
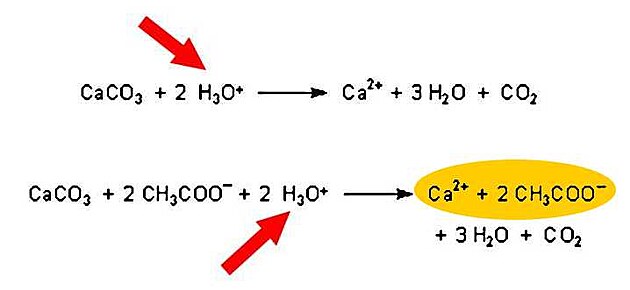
Tímto protonem je pak napaden karbonát v perleti. Volný vápník se může spojit se zbytkem molekuly, která byla dříve octovou kyselinou, zatímco se do vody uvolňuje oxid uhličitý.
Je tedy jen logické, že tato reakce funguje tím lépe, čím více volných molekul vody je v roztoku k dispozici. Jinými slovy - zředěná kyselina je při rozpouštění perel účinnější než koncentrovaná varianta.
Právě proto rozpustíte perlu běžným octem daleko lépe než koncentrátem. Plastové perly samozřejmě tímto způsobem s octem nereagují, ráno je tedy najdete v hrníčku prakticky neporušené.
align="justify"
Dana Tenzler
Bludná planeta - první kandidát na osamělou planetu podobnou Zemi

| Další články autora |

Akční letáky
Prohlédněte si akční letáky všech obchodů hezky na jednom místě!
Střední školy
Nepřehlédněte
- Prezidentské volby v Panamě vyhrál spojenec exprezidenta odsouzeného za korupci
- Zákaz prodeje HHC nabídku v automatech neomezil. Zákazníkům ale nabízí jiné zboží
- Do růžové. Proč měl Pogačar černou pásku a proč oponoval Contadorovi
- Katar plánuje vyhoštění lídrů Hamásu, ale není kam. Jordánsko je zpět nechce
- Ani vás nepustí do haly. Podvodů při prodeji lístků na MS v hokeji přibývá
- K proměně jihokorejského průmyslu přispěl i Doosan, využívá turbíny z Česka
- Cizinci ze zemí mimo EU si už českou zemědělskou půdu nekoupí
- Za bydlení politiků platíme tisíce, vládní byty a vily mnozí z nich nevyužívají