- Napište nám
- Kontakty
- Reklama
- VOP
- Osobní údaje
- Nastavení soukromí
- Cookies
- AV služby
- Kariéra
- Předplatné MF DNES
Chemie na silnicích - zimní solení
Můžete to ověřit vlastním pokusem. Pokud vezmete kousek ledu z mrazáku, posolíte ho slabou vrstvičkou kuchyňské soli a dáte ho zpátky - začne během půl hodiny tát - a to navzdory tomu, že je ve stejně mrazivém okolí, ve kterém se předtím vytvořil z vody led.
Zamrzání vody
Zamrzající voda se chová na první pohled podivně. Asi nejvíc upoutá anomálií, která se týká její hustoty.
Naprostá většina látek kolem nás má při nižších teplotách vyšší hustotu. Existuje ale také řada látek, které při přechodu do pevného skupenství svou hustotu zprvu sníží. Mezi ně patří například vizmut, gallium, germanium, plutonium, křemík, tellur nebo slitina, které se říká Woodův kov. Nejznámějším zástupce takových látek - je ovšem voda.
Při ochlazování se hustota tekuté vody pozvolna zvyšuje - až do určité teploty. Při 4 °C pak nastává zlom - a hustota se začne zase snižovat. Vysvětlení je jednoduché - při této teplotě se začnou chaoticky rozházené molekuly v tekutině rovnat do uspořádaného stavu, jaký známe z krystalických látek. Když se podaří všem molekulám najít uspořádaný stav - má nakonec led (krystalická voda) o přibližně 11 % větší objem než voda v tekutém stavu.
Proč taje posolený led?
Na vině je - a to bude možná překvapením - atmosféra naší planety. Posolené silnice zůstávají mokré a bez nebezpečného náledí díky tomu, že má naše planeta dostatečně hustou atmosféru.
Když zapůsobíte na led (krystalickou formu vody) tlakem z vnějšku, mohou jeho krystaly ztratit své uspořádání a dostat se do původně chaotického stavu (stavu, který panuje v tekutině).
Jinými slovy - led, který někdo umístil do lisu, začíná tát i při nízké teplotě.
V přírodě tento “lis” nahrazuje atmosféra. Na 1 čtvereční centimetr povrchu působí díky ní síla, odpovídající přibližně tíze závaží o hmotnosti 1 kg. Organismy, které žijí na zemském povrchu, jsou na tento tlak zvyklé, proto ho prakticky nevnímají.
Led se tedy v přírodě nachází pod neustálým tlakem, takže se na jeho povrchu nachází tenká vrstvička vody.
Když se na led nasype vrstvička soli, snaží se sůl v této vodě rozpustit. Tím se narušuje rovnováha mezi tekutou a pevnou formou vody. Na ledovém krystalu se tvoří další vrstva tekuté vody, ve které se rozpouští další sůl. Proces pokračuje tak dlouho, dokud se nerozpustí celý ledový blok nebo se nevyčerpá zásoba soli.
Výsledkem je pak solanka - voda, ve které je rozpuštěná kuchyňská sůl (NaCl). A ta může být tekutá ještě při teplotách kolem -21 °C.
Proč nezamrzá solanka při teplotách do -21 °C?
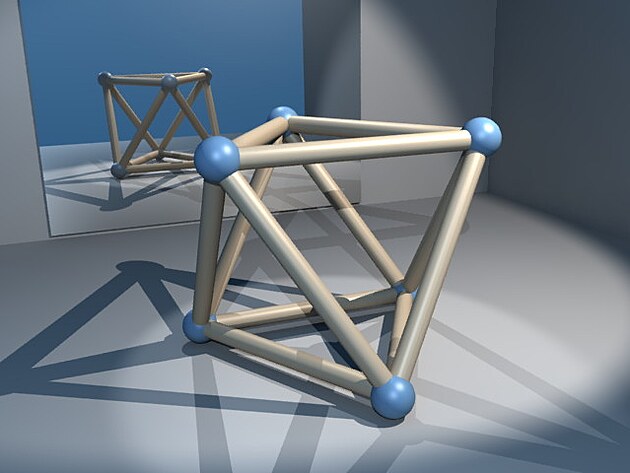
V roztoku soli se sůl nachází v disociovaném stavu. Její molekula už není vcelku, ale rozdělila se na ionty sodíku a chloru, které jsou obklopené molekulami vody. Ty totiž nejsou úplně neutrální. Voda vytváří tzv. dipól, část její molekuly má spíše kladný a část záporný náboj. Struktura solanky je překvapivě uspořádaná - kolem každého iontu sodíku nebo chloru se shlukne šest vodních dipólů. Vytvoří tak oktaedrální strukturu (viz obrázek: oktaedr).
Aby mohla taková tekutina s uspořádanou strukturou zamrznout, musela by se nejprve své struktury zbavit. A to je poměrně složité. Ionty soli a vodní molekuly spolu drží díky elektromagnetické síle, která působí mezi kladnými a zápornými náboji. K rozbití struktury by tedy byla potřeba další energie, kterou podchlazený systém neoplývá. Až relativně hodně nízká teplota (kolem -20 °C) dává systému dostatečný důvod, aby se začaly tvořit krystaly ledu.
Posolené silnice tedy zůstávají pro řidiče bezpečné … díky elektromagnetismu, jedné ze základních vesmírných sil.
Dana Tenzler
Bludná planeta - první kandidát na osamělou planetu podobnou Zemi

| Další články autora |

PRACOVNÍK PODPORY PRODEJE (A12500)
AURES Holdings a.s.
Olomoucký kraj
nabízený plat:
30 000 - 32 000 Kč
Střední školy
Nepřehlédněte
- Pasti plné švábů, plíseň a nedopalky. Inspekce zavřela libereckou pizzerii
- Pár nemohl mít děti, v náhradní péči vychoval čtyřiasedmdesát nevlastních
- Konečný opouští Spartu, míří do Komety za vidinou většího prostoru
- Festival ve Zlíně poctí Polívku či Bočana a předznamená olympiádu
- Hirscherova výzva. Co obnáší změna zemí? A kdy získá místo mezi elitou?
- Kamion na Rozvadovské spojce skončil ve svodidlech, vyprošťovali ho jeřábem
- Bývalý manžel mi vybral toho současného, říká herečka Kristýna Ryška
- Měl jsem dát do stanov TOP 09 právo zakladatele ji rozpustit, píše Kalousek