- Napište nám
- Kontakty
- Reklama
- VOP
- Osobní údaje
- Nastavení soukromí
- Cookies
- AV služby
- Kariéra
- Předplatné MF DNES
Chemie v garáži - proč rezaví auto víc v zimě než v létě?
Železo je úžasný kov. Je to nejtěžší z prvků, které se samovolně tvoří v nitru obřích hvězd. Je totiž posledním prvkem, při jehož syntéze se uvolňuje (pro hvězdu užitečná) energie. Tím se také vysvětluje poměrně vysoké zastoupení železa v našem světě. Užitečný kov má ale jeden problém - rezaví a ztrácí tak vlastnosti, za které si ho ceníme.
Proč rezaví železo? Jen tři elektrony - a kolik způsobí starostí.
Koroze železných předmětů je vlastně chemická reakce, které se odborně říká…
… oxidace.
Probíhá při ní výměna elektronů mezi železem a kyslíkem. Možná si vzpomenete na jeden z minulých blogů a na párty, kterou pořádá v molekule vody kyslík. Něco podobného zkouší kyslík i na plechy vašeho auta.
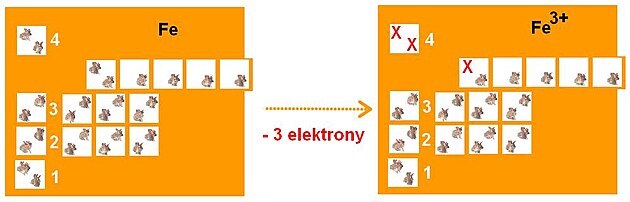
Stejně jako je tomu u každého jiného prvku, jsou vlastnosti železa dané složením jeho atomů. 56 nukleonů (26 protonů a 30 neutronů v jádře) vyvažuje 26 elektronů v jeho atomovém obalu. Ne všechny mají ale stejné chování. Za ochotu železa rezavět mohou jen tři.
Elektronový hotel “Iron City”
Všechny elektronové hotely (elektronové obaly jednotlivých chemických prvků) jsou postaveny podle stejných plánů. Liší se jen počtem pater a počtem obsazených pokojů (chemik jim říká atomové orbitaly). Stavební plány jsou už hodně staré - a proto ve všech hotelech chybí výtah.
Elektrony (stejně jako lidé) nerady chodí po schodech, a tak obsazují nejprve spodní patra. Teprve ty, na které se nedostalo místo, se ubírají do vyšších pater. V tom nejvyšším pak rády obsazují pokoje po jednom.
Ve dvou nejvyšších patrech (odkud je dobrý výhled, což bude důležité pro pozdější vývoj situace), bydlí v Iron City dohromady 8 elektronů.
Ne všechny jsou spokojené. Některé z nich jsou osamělé a nudí se. Zároveň vidí u svých sousedů, jak to může být skvělé, bydlet po dvou.
Chemická vazba mezi kyslíkem a železem
Není tedy divu, že se poohlížejí po ostatních hotelech. I tam se totiž nacházejí poloobsazené pokoje - a v nich znuděné elektrony, dychtivé jakékoliv zábavy.
Kyslík je prvek, o kterém je známo, že je velice pohostinný. V jeho “hotelu” se konají skvělé párty na kterých teče alkohol a sodovka proudem - a je tu místo pro dva další cizí elektrony. Je jen logické, že jakmile se nedaleko objeví atom kyslíku, elektrony v atomu železa prostě neodolají a …
...vytvoří s ním chemickou vazbu.
Nejlepší výhled v Iron City je z malé komůrky vlevo nahoře, z pokoje, označeného jako 4s (4. patro, atomový orbital typu “s”). Nejlepší šanci, aby si všimly mejdanu, pořádaného atomem kyslíku, tedy mají paradoxně ty dva elektrony, které už bydlí ve dvojici - chemik by o nich řekl, že mají …
nižší aktivační energii, než mají elektrony v pěti ostatních nejvyšších pokojích.
Nejprve odejdou tedy na párty, kterou organizuje kyslík, tyhle dva elektrony. Následuje je pak elektron žijící ve dvojici v levém pokoji. Může se to zdát nelogické, i on má totiž partnera a měl by být teoreticky spokojený. Tenhle elektron má ovšem ještě sbaleno (možná se ještě nerozhodl, ve kterém z pěti pokojů se mu líbí nejvíc) a jeho odchod proto nezabere moc času nebo námahy. Chemik ví, že i tenhle elektron má relativně…
nízkou aktivační energii.
Jak je vidět na horním obrázku - po odchodu tří elektronů je hotel obsazen víceméně spravedlivě. Ne že by byly osamělé elektrony ve vrchním patře vyloženě šťastné…
ale alespoň si nemohou vzájemně závidět.
Závist je silná emoce. Dokonce i v elektronovém světě. K tomu, aby teď mohl atom železa opustit další elektron, musí jeho chemický partner vynaložit buď značné úsilí, nebo musí mít v záloze připravený nějaký opravdu vykutálený trik.
Proto se v našem světě skládá rez ze směsi dvou oxidů železa: FeO (kde chybí železu dva elektrony) a Fe2O3 (kde mu chybí elektrony tři). Přitom je ta “spravedlivější” forma také daleko častější.
Fyzikální zákony v našem vesmíru tedy doslova nutí železo, aby korodovalo. Stačí k tomu přítomnost kyslíku, prvku, který rád krade cizí elektrony a pořádá exotické párty.
Vzhledem k tomu, že kyslíku je v naší atmosféře opravdu dost - musíme pro změnu my lidé vynaložit značné úsilí, abychom železo před svůdníkem kyslíkem ochránili. Naštěstí nemusíme svoje auto hlídat se vzduchovkou. Ochranu nabízí různé neprodyšné laky. Jelikož nic není věčné a kvalita laku se v průběhu let snižuje, zvyšuje se i šance na divokou párty pro atomy železa v karoserii vašeho auta.
Proč ale auto koroduje v zimě rychleji než v létě?
Hrátky kyslíku se železem urychluje hned několik faktorů. Je to například přítomnost kyseliny, jiného (vzácnějšího) kovu nebo neutrální soli. Hned dva z těchto pomocníků nachází kyslík na našich zimních zasolených ulicích. To je také jednoduchý důvod, proč vaše auto rezaví daleko rychleji v zimě než v létě. Zatímco kyselý déšť na auto padá i v létě, v zimě se k němu přidává další pomocník - a to sůl. A ten je nejen ochotný, je také velice pilný.
Koroze pomocí kyseliny
Přitom je zajímavé, že samotná kyselina (a to dokonce i poměrně silná a koncentrovaná kyselina) by vašemu autu moc neuškodila, nebýt všudypřítomného kyslíku.
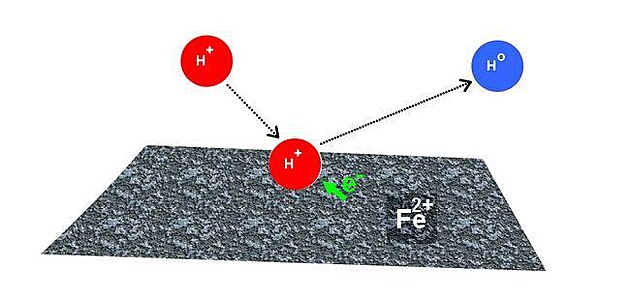
Charakteristikou kyseliny jsou volně nabité ionty vodíku, které se mohou podílet na chemické reakci.
Takové ionty si sice mohou z povrchu železného předmětu “ukrást” elektrony - přitom se ale povrch železa pokrývá vrstvičkou kladně nabitého železa II+ (kterému chybí dva elektrony z výše zmíněného pokoje v levé části vrchního patra hotelu). Kladné náboje se vzájemně odpuzují - takže další krádeže elektronů se už kyselině nepodaří. Okradené a nyní kladně nabité atomy železa vytváří na povrchu ochrannou vrstvu, která zahání zloděje elektronů na útěk.
Také voda tvoří slabou kyselinu. Její molekuly mají sklon se rozpadat na kladně nabité vodíkové a záporně nabité ionty.H2O ———> H++ OH-
V úplně čisté (destilované) vodě jich ale není moc.
Rychlá, rychlejší, nejrychlejší - jaká koroze schroupá vaše auto nejdřív?
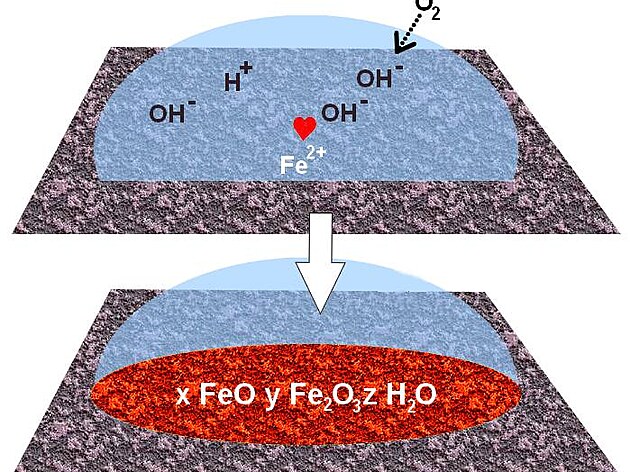
Drastičtější situace nastává, když se do věci vloží výše zmiňovaný kyslík. Ve vodném roztoku, ve kterém se už potulují různé ionty (H+, OH- a Fe2+) pak začne probíhat následující chemická reakce
1 O2+ H2O + 2 e-———> 2 OH-
Výsledkem jsou další a další ionty OH-. Netrvá to dlouho - a objeví v roztoku zajímavého partnera: ionty Fe2+. Vytvářejí spolu sloučeninu Fe(OH)2, ze které se pak další reakcí s kyslíkem a odštěpením molekuly vody stává směs obou oxidů železa 2+ a železa 3+. Ty se ukládají na povrchu kovu a tvoří pověstnou rez (viz následující obrázek).
Přímo optimální podmínky pro korozi pak nastanou, pokud se do vody přimíchá kuchyňská sůl - NaCl.
Tato sloučenina se ve vodě rozpadá na kladně a záporně nabité ionty, které se mohou volně pohybovat a přenášejí elektrický náboj tam, kde je zrovna potřeba.
Pokud předtím panovala v kapce vody párty, při které se mohly seznamovat nezadané ionty Fe2+ a OH- … mění se přidáním soli párty na nezřízený divoký mejdan, kde padají poslední zábrany.
Nakonec reagují všichni se všemi, tančit přichází další kyslík, únavou odpadá voda. Výsledek, který vidíte v dolní části horního obrázku (a kterému říkáme “rez”), pak nutně vypadá stejně, jako se cítíte vy po obzvláště vydařené oslavě.
Dana Tenzler
Co způsobuje barvu minerálů (4) - klamání tělem a přibarvování reality

Dana Tenzler
Co způsobuje barvu minerálů (2) - proč jsou vlastně děti zlobivé?

| Další články autora |

Rozdáváme samoopalovací fluid ZDARMA
Toužíte po dokonalé letní barvičce bez rizika spálení? Vyzkoušejte lehký přírodní samoopalovací krém na obličej i tělo od Manufaktury. Zapojte se...
Střední školy
Nepřehlédněte
- Střelec na Fica přiznal vinu. Premiérův stav se lepší, převoz ještě není možný
- ONLINE: Lotyšsko - Švédsko 2:6. Tři góly za 26 sekund! A další ránu přidal Pettersson
- Sudetští Němci na sjezdu pochválili dialog s Čechy. Zahráli i českou hymnu
- ONLINE: Druhá časovka. Profil nahrává rovinářům, na trati už bojuje Černý
- ONLINE: Dánsko - Švýcarsko 0:5. Hvězdy z NHL pálí, pátý gól dal Senteler
- Soud poslal do vazby muže podezřelého z pobodání řidiče v Rokycanech
- Jako dvě hrdličky. Richard Gere září v Cannes po boku o 33 let mladší Španělky
- Foden z Manchesteru City získal cenu pro nejlepšího hráče Premier League